ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- クライオ電子顕微鏡による小胞型モノアミン輸送体の分子基盤解明 ―シナプス小胞における神経伝達物質の輸送機構を可視化―
プレスリリース
2024.09.17
クライオ電子顕微鏡による小胞型モノアミン輸送体の分子基盤解明 ―シナプス小胞における神経伝達物質の輸送機構を可視化―
概要
京都大学大学院医学研究科 林到炫 (イム ドヒョン) 助教、Mika Jormakka 同特定准教授、浅田秀基 同特定准教授、岩田想 同教授(兼 理化学研究所放射光科学研究センターグループディレクター) の研究グループは、岡山大学自然生命科学研究支援センターの樹下成信 助教、宮地孝明 研究教授、大阪大学蛋白質研究所 加藤貴之 教授、京都工芸繊維大学 応用生物学系 岸川淳一 准教授、京都大学医生物学研究所 野田岳志 教授、杉田征彦 同准教授 (兼: 白眉センター准教授) らとの共同研究によりヒト由来小胞型モノアミントランスポーター2 (VMAT2)1) の立体構造を、クライオ電子顕微鏡法 (cryo-EM)2) を用いて解明することに成功しました (図1)。VMAT2は、ドパミンなどの神経伝達物質をシナプス小胞に輸送する重要な膜タンパク質であることから、精神疾患や神経変性疾患に関わる治療薬の標的分子とされています。本研究では、VMAT2の立体構造をアポ状態、ドパミン結合状態、阻害薬テトラベナジン結合状態の3つの状態で明らかにし、VMAT2の基質輸送機構および阻害薬による阻害機構を理解することができました。ドパミンの結合部位やプロトン結合推定部位の情報は、新薬開発において特に重要であり、精神疾患や運動障害に対する新しい治療法の創出が期待されます。
本研究成果は、2024年9月16日に国際学術誌「Nature Communications」にオンライン掲載されました。
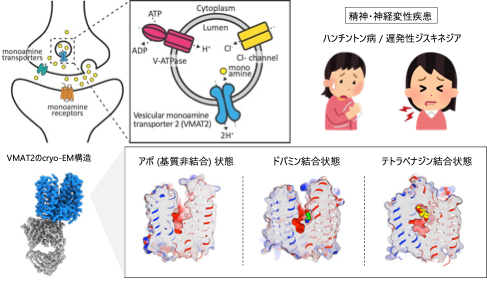
図1. シナプス小胞における神経伝達物質の輸送を担当するVMAT2のcryo-EM構造
1.背景
小胞型モノアミントランスポーター2 (VMAT2) は、神経細胞末端において細胞質からシナプス小胞にモノアミン (ドパミン、セロトニン、ヒスタミン、ノルアドレナリンなどの神経伝達物質) を輸送する膜タンパク質です。VMAT2の働きによって神経伝達物質はシナプス小胞内に貯蔵、運搬され、シナプス間隙への開口放出に備えることが可能になります。神経細胞における神経伝達物質の適切な制御は、精神疾患や神経変性疾患において極めて重要だと考えられています。VMAT2の阻害薬はVMAT2の特定認識部位に結合することでこの機能を抑制し、神経伝達物質の小胞内吸収を抑制しますが、シナプス小胞内への神経伝達物質の貯蔵を妨げ、開口放出による神経伝達物質の分泌量が減少することでシナプス間隙における神経伝達物質の濃度を減らします。その結果、過剰な神経伝達物質の分泌によって発症するハンチントン病や抗精神病薬による遅発性ジスキネジアなどの中枢神経疾患の治療において重要な役割を担います。VMAT2は神経細胞末端において神経伝達物質を制御する中心的役割を担っており、重要な創薬標的分子とされていますが、現在上市されているVMAT2に対する治療薬は、その効果の反面、神経伝達物質の過剰な抑制による副作用も指摘されています。私たちの研究チームでは、VMAT2の基質輸送機構および阻害薬の阻害機構の分子基盤を明らかにし、より効果的な治療薬開発に資する構造情報の取得を目指しました。
2.研究手法・成果
本研究では、クライオ電子顕微鏡 (cryo-EM) を用いて、VMAT2の立体構造を原子レベルで明らかにすることに成功しました。Cryo-EMは、タンパク質の立体構造を決定する革新的技術として2017年にノーベル化学賞を受賞した方法です。Cryo-EMは、膜タンパク質の構造決定法として非常に強力な技術であり、VMAT2のような輸送タンパク質を含む多くの膜タンパク質の構造決定に利用されています。今回、スクリーニング測定用と本測定用の2種類のクライオ透過型電子顕微鏡 (cryo-TEM) を用いた効率的な構造決定法を確立しました。スクリーニングcryo-EMでは京都大学医生物学研究所に設置されているGlacios cryo-TEM (加速電圧200keV) を用いて野田岳志 教授、杉田征彦 准教授らと、本測定cryo-EMでは大阪大学蛋白質研究所のTitan Krios cryo-TEM (加速電圧300keV) を用いて加藤貴之 教授、岸川淳一 准教授 (京都工芸繊維大学) らとの連携により、VMAT2の構造が決定できました。さらに、今回はcryo-EMによる膜タンパク質の構造解析をより体系的に行うツールとして、VMAT2の立体構造を特異的に認識する抗体を作製し、これをcryo-EM解析に活用することで構造解析がより容易になりました。
今回、私たちはVMAT2のアポ (基質非結合) 状態、ドパミン結合状態、阻害薬であるテトラベナジン結合状態の3種類の状態の立体構造をそれぞれ最大分解能3.05 Å3), 2.90 Å, 3.18 Åで決定しました。VMAT2は膜貫通ヘリックス (Transmembrane helix: TM) 1~6からなるN末端ドメインと、TM6~12からなるC末端ドメインで構成されており、両ドメインに囲まれた領域に中心空洞が形成されていました (図2)。この中心空洞にドパミンが結合することから、この領域を介して基質の輸送が行われると考えられました。岡山大学自然生命科学研究支援センターの樹下成信 助教、宮地孝明 研究教授らによる、ドパミンとの相互作用解析、点突然変異の導入による輸送活性の変化を測定することで、モノアミンの輸送に重要なアミノ酸残基を同定することに成功しました。特に、ドパミンのカテコール基と塩基性アミノ酸残基との間で形成される水素結合や塩橋が、ドパミンの安定的な結合に寄与していることが示されました (図3)。さらに、VMAT2の阻害剤であるテトラベナジンが結合した構造から、テトラベナジンがVMAT2の中央空洞全体を占めるように結合することで、広範な構造変化を引き起こすことが明らかになりました。この結合様式および構造変化は、テトラベナジンによるVMAT2の輸送阻害機構についての理解を深めるものです。一方、VMAT2が基質を輸送するためには2つのプロトンが必要であると考えられていましたが、今回の結果からプロトン結合部位としてAsp426およびAsp399のアミノ酸残基が推定できました (図4)。さらに、これらの残基がVMAT2の輸送サイクルにおいて、構造変化を引き起こすための重要な役割をになう可能性が示唆されました (図5)。
3.波及効果、今後の予定
高齢者社会であると言われる昨今、脳から発病する精神・神経変性疾患は年々増加しており、これらへの対応は社会的要請となっています。しかし、それらの疾患と原因タンパク質の関連性については不明な点が多く残されています。今回の研究で、cryo-EMによるVMAT2の構造解析、基質・阻害剤の相互作用解析、輸送活性測定やpKa予測などの様々な手法を組み合わせることによって、VMAT2の基質輸送機構および阻害薬による阻害機構の分子基盤を明らかにすることができました。これらの結果は、これまでに培ってきたVMAT2の知見をより深化させるものであると考えられます。上述のようにVMAT2はハンチントン病や遅発性ジスキネジアなどの中枢神経疾患の治療標的として知られており、これら疾患に関連する新規治療法の開発においても貢献可能であると考えられます。特に、現代の新薬開発過程において標的タンパク質の立体構造情報に基づいた医薬品の設計(Structure-Based Drug Design: SBDD)4) は、より特異的で効果的な薬剤の設計を可能とするため新薬開発プロセスに重要な位置を占めていることから、複数のVMAT2の詳細な構造情報が明らかにされたことで、既存の薬剤 (例えば、テトラベナジン、レセルピン) の作用機序がより深く理解されるだけでなく、新規の阻害剤やモジュレーターの開発が加速する可能性があります。特に、私たちが特定したドパミン結合部位やプロトン結合推定部位は、新薬開発のための有望な標的領域となる可能性があります。これにより、現在治療が困難とされる精神疾患や運動障害に対する新しい治療法が登場することが期待されます。
4.研究プロジェクトについて
本研究は、文部科学省科学研究費助成事業(19H00923 [岩田], 22KK0099, 23K06357 [林])、AMED研究事業(JP23ama121007 [岩田], 23809479 [林], JP23ama121001 [加藤]) の支援を受けて行われました。
<用語解説>
- 1) 小胞型モノアミントランスポーター (Vesicular monoamine transporter: VMAT)
小胞型モノアミントランスポーターは、細胞質で合成されたモノアミン (ドパミン、セロトニン、ヒスタミン、ノルアドレナリンなどの神経伝達物質) を開口放出に備えて小胞内に輸送、貯蔵する輸送タンパク質で、神経細胞末端にあるシナプス小胞に存在するVMAT2と、副腎のクロム親和性細胞の有芯小胞でみられるVMAT1の2種類に分類されます。VMATは精神・神経変性疾患の分子標的として注目されています。 - 2) Cryo-EM (Cryogenic electron microscopy)
クライオ電子顕微鏡法。タンパク質などの凍結した生体試料に電子線を照射し、試料の観察を行うために透過電子顕微鏡(TEM)を用いる。試料から得られた2次元投影像を単粒子解析技術により3次元再構成し、生体分子の立体構造を決定する。 - 3) Å (オングストローム)
1 Åは100億分の1メートル。構造解析分野においては高次構造の解像度を示す単位として用いられる。数字が小さいほどより高解像度の立体構造であることを示す。 - 4) SBDD (Structure-Based Drug Design)
SBDD、つまり“構造ベース創薬”とは、新しい医薬品を創製する時に標的となるタンパク質などの生体分子の立体構造を解析した上で、その構造情報を考慮して化合物などの医薬品を設計する創薬手法を示します。
<研究者のコメント>
私たちの研究チームが挑戦した今回の研究は、精神・神経変性疾患の治療法開発における重要な一歩を踏み出すものでした。VMAT2という小胞型モノアミントランスポーターの立体構造を明らかにすることで、これまで解明されていなかった神経伝達物質の輸送メカニズムや、阻害薬の作用機構に新たな知見を提供できたことを大変嬉しく思います。この研究を通じて感じた最大の喜びは、複雑で挑戦的な課題に取り組み、その結果として得られた発見が、医薬品の開発において実際に役立つ可能性があるということです。特に、cryo-EMを駆使して原子レベルでの構造を解明したことは、私たちの研究の中でも最もアピールしたい成果の一つです。もちろん、この研究を進める上で多くの困難に直面しました。新しい技術を駆使しながら、データの解析や実験条件の最適化に多くの時間と労力を費やしました。特に、膜タンパク質であるVMAT2の構造解析は非常に難解で、多くの試行錯誤が必要でした。しかし、それらの壁を乗り越えることで得られた成果は、チーム全員に大きな達成感をもたらしました。精神疾患や神経変性疾患の治療は、今後ますます重要になることが予想される中、今回の研究が新薬開発への基盤を提供できることを強く期待しています。また、将来的には、今回の成果を基にさらなる治療法の革新が進み、より多くの患者さんの生活の質を向上させることができればと願っています。
<論文タイトルと著者>
タイトル:Neurotransmitter Recognition by Human Vesicular Monoamine Transporter 2(ヒト由来小胞型モノアミントランスポーター2による神経伝達物質の認識機構)
著 者:Dohyun Im, Mika Jormakka, Narinobu Juge, Jun-ichi Kishikawa, Takayuki Kato, Yukihiko Sugita, Takeshi Noda, Tomoko Uemura, Yuki Shiimura, Takaaki Miyaji, Hidetsugu Asada and So Iwata
掲 載 誌:Nature Communications DOI: 10.1038/s41467-024-51960-z
<参考図表>
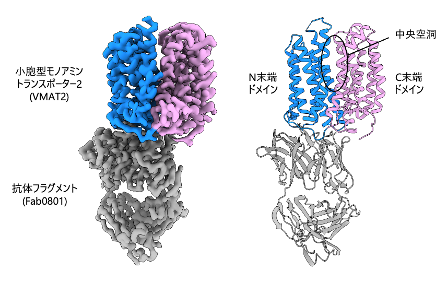
図2. Cryo-EM解析によるVMAT2の立体構造
細胞膜側から見たVMAT2のcryo-EM密度マップ (左) とその分子モデル (右)。VMAT2の構造はN末端側のドメインとC末端側のドメインで構成されており、その間に中央空洞を形成していることが特徴的です。構造解析用のツールとして用いられた抗体フラグメントは細胞質側でVMAT2と結合しています。
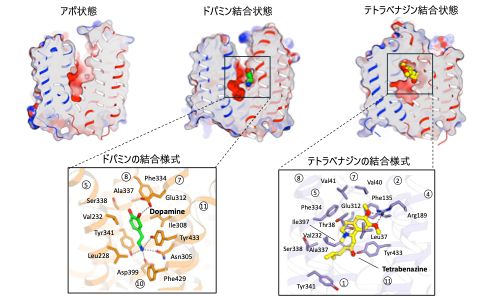
図3. 本研究で明らかにしたVMAT2の3種類の異なる状態の構造
本研究では基質結合なしのアポ状態、基質のドパミン結合状態、阻害剤のテトラベナジン結合状態の構造をそれぞれ解明しました。ドパミンはVMAT2の中央空洞の一部を占めており、そのカテコルアミンがAsp399と塩橋を、Asn305と水素結合を形成することで安定的に結合しています。一方、テトラベナジンはVMAT2の中央空洞全体を占めていることが特徴的で、その異なる結合様式によりVMAT2の全体構造は大きく変化し、細胞外領域が閉じられた閉鎖構造をとっています。
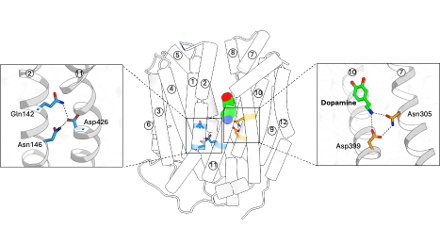
図4. VMAT2におけるプロトン結合の推定残基
基質結合状態のVMAT2構造を安定化する2つの残基Asp426およびAsp399に注目し、機能解析を行うことでこれらが基質輸送に必要なプロトンの結合部位である可能性を提示しました。
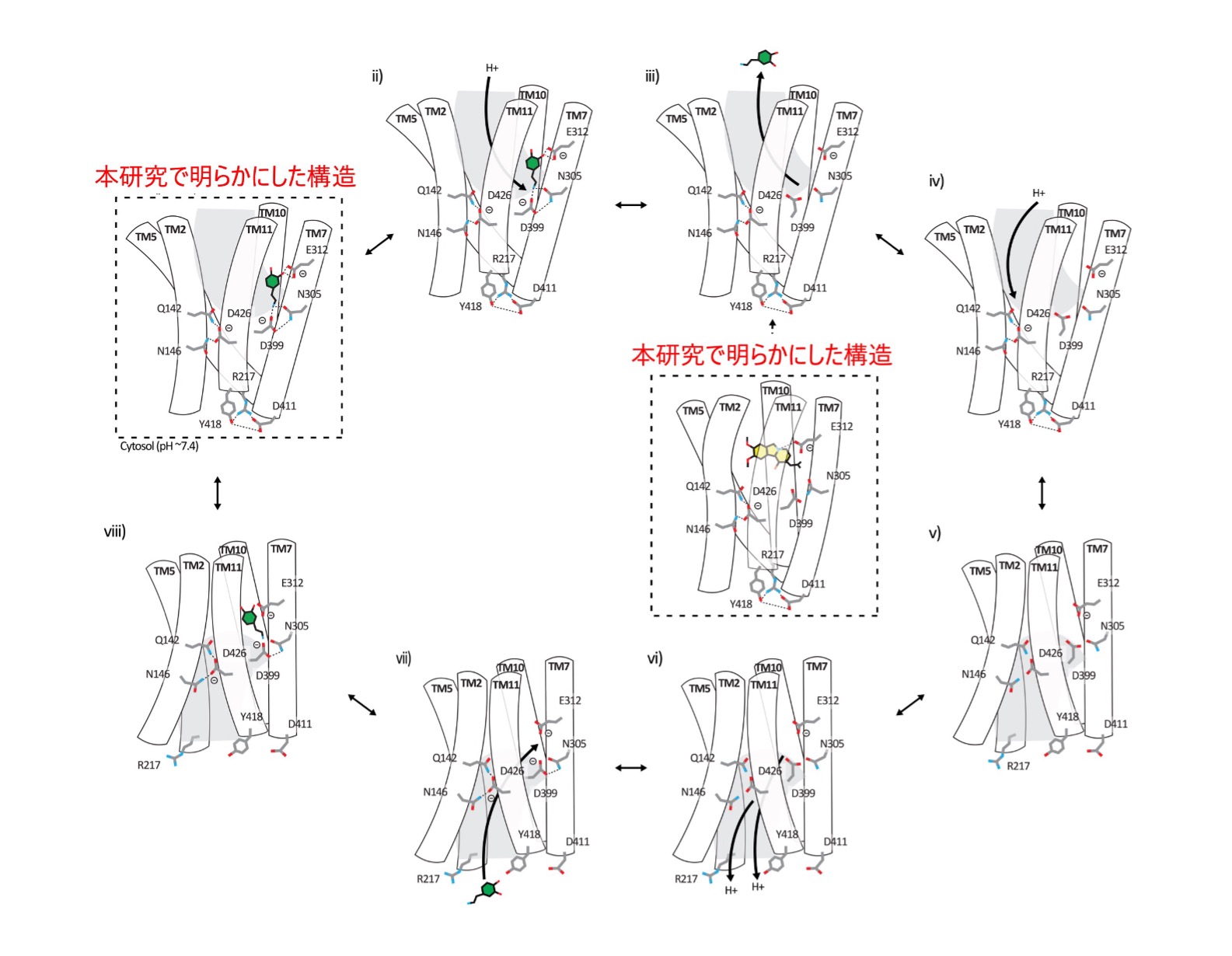
図5. VMAT2の交互輸送メカニズムの提案
VMAT2の輸送サイクルの中で期待されるコンフォメーション状態を示す模式図です。破線は本研究で明らかになった構造で、他のパネルは我々の知見と関連トランスポーターに関する先行知見に基づいて推測されたものです。
電子線構造生物学研究室(加藤研):http://www.protein.osaka-u.ac.jp/cryoem/index2.html






