ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- 痛みや痒みを調節する受容体の構造を解明 ~神経障害性疼痛や肺がんなどの治療薬開発に光~
プレスリリース
2022.07.26
痛みや痒みを調節する受容体の構造を解明 ~神経障害性疼痛や肺がんなどの治療薬開発に光~
国立大学法人東海国立大学機構 名古屋大学細胞生理学研究センター/大学院創薬科学研究科の大嶋 篤典 教授、田中 康太郎 助教、鈴木 翔大 博士後期課程学生は、大阪大学蛋白質研究所の加藤 貴之教授、川本 晃大助教との共同研究で、痒みや痛みのシグナル伝達を担うMas関連Gタンパク質共役型受容体D(以下、「MrgD」)とGタンパク質注1)の複合体を構造解析し、そのリガンド注2)認識機構を解明しました。MrgDはこれまで構造が報告されているGタンパク質共役型受容体(GPCR)注3)では見られなかったリガンド結合形態を有しており、新奇なリガンド認識、活性化機構を持つことが示唆されました。
MrgDは、心血管系疾患や過敏性腸症候群などの治療薬の標的候補として期待されていますが、そのリガンド認識機構とMrgDの構造は不明でした。本研究では、MrgDにβ-alanine注4)が結合した状態と、リガンド非結合状態の2つのMrgDの原子構造をクライオ電子顕微鏡を用いた単粒子解析注5)によって解明しました。その結果、MrgDは一部が溶媒にさらされた非常に浅い結合ポケットを形成していることが明らかになりました。本研究によりGPCRの理解が進むとともにMrgDを標的とした薬剤開発の進展が期待されます。
本研究成果は、2022年7月15日付で学術雑誌「Communications Biology」に掲載されました。
本研究は、文部科学省科学研究費補助金「基盤研究B」、日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業・創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援のもとで行われたものです。
ポイント
・痒み刺激に応答する膜タンパク質・MrgDの構造と機能を解明した。
・典型的なGPCRとは異なるリガンド認識、活性化機構を持つことが示唆された。
・本研究により、神経障害性疼痛や肺がんなどの治療薬開発の進展が期待される。
研究背景と内容
GPCRは、ヒトに約800種類存在し、最大の遺伝子ファミリーを形成している膜タンパク質群です。GPCRは各々が異なるリガンドを認識し受容することで活性化され、細胞内のエフェクター因子である三量体Gタンパク質を活性化し、生体内の多様な生命現象を制御しています。また、既存薬の標的の約4割をGPCRが占めており、創薬標的としても魅力的な分子として研究が盛んに行われています。Mas関連Gタンパク共役型受容体(MRGPR)注6)は脊髄後根神経節に発現が確認され、痛みや痒みのシグナルを担うと報告されています。MRGPRの一つであるMrgDは、脊髄後根神経節や心血管系、網膜神経細胞などに発現し、痛みや痒みのシグナル伝達を行うだけでなく、血圧の調節や網膜毛細血管の維持にも関与することが報告されています。またMrgDは肺のがん組織で高発現しており腫瘍形成への関与も示唆されています。しかし、MrgDを標的とした低分子薬剤は存在せず、そのリガンド認識機構とMrgDの構造は不明であり、医薬品開発が阻まれていました。
本研究ではクライオ電子顕微鏡による単粒子解析により、内在性リガンドβ-alanine、ヒト由来MrgD受容体、ヘテロ三量体Giタンパク質からなるシグナル伝達複合体の原子構造を決定しました。これによりMrgDによるβ-alanineの認識機構と、活性化したMrgDよるシグナル伝達機構を解明しました。MrgDは典型的なGPCRと同様に7本の膜貫通ヘリックス(TM1~TM7)からなり、TM6はGタンパク質が結合できるように外側に開いた活性型構造を取っていました(図1)。MrgDのリガンド結合ポケットは非常に浅く、リガンド結合ポケットの一部は溶媒側にさらされた構造を取り、これまで報告されたGPCRでは見られない特徴的なポケットを形成していました(図2)。さらに、MDシミュレーション注7)の結果、小さなリガンド、浅い結合ポケットでありながらも、β-alanineは非常に安定に結合することが確認されました。Class A GPCRに高度に保存されているトグルスイッチ(W6.48)注8)と呼ばれるTM6の中心に位置するトリプトファンがMrgDではセリンに置換されており、このセリンとリガンドとの距離も他のGPCRと異なり離れていることがわかりました(図2)。変異体解析により、MrgDの活性化に重要なのは、より細胞側に存在するW241を含むTM3-TM6間の疎水性アミノ酸残基の相互作用であることが明らかとなりました。これらの結果から、MrgDのリガンドの認識や受容体活性化のスイッチの機能がトグルスイッチを持つ他のGPCRとは異なる独特な機構による可能性が示唆されました(図3)。
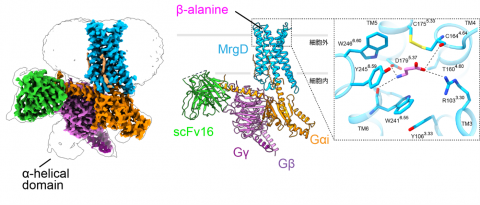
|
図1 MrgD-Giシグナル伝達複合体の全体構造。 (左)クライオ電子顕微鏡マップを膜平面方向から見た図。 (右)原子構造のリボンモデルとリガンド結合部位の拡大図。 |
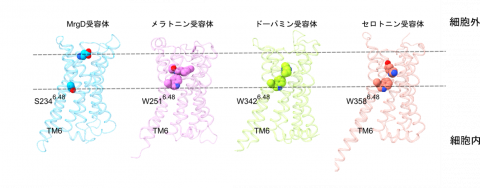
|
図2 活性型のClass A GPCRの構造とリガンド結合部位の位置の比較。 Class A GPCRに高度に保存されているTM6のトリプトファンがMrgDではセリンになっている。さらにMrgDのリガンドは他の受容体と比較してより細胞外に結合し、トグルスイッチの位置から大きく離れている。点線はβ-alanineの位置(上側)、トグルスイッチのセリンの位置(下側)をそれぞれ示している。 |
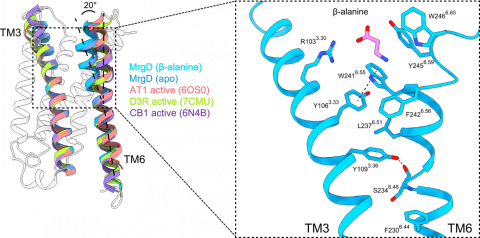
|
図3 MrgDの特徴的なTM3-TM6の相互作用 (左)代表的な活性型Class A GPCRの重ね合わせ。TM6の細胞内側は一致するが、細胞外側は約20°TM3側に傾くという特徴的な配置をとる。 (右)MrgDのTM3-TM6間の相互作用。変異体解析により、疎水性残基 (Y106, Y109, F242, W241, Y245, W246)がMrgDの活性化に重要であることを示した。 |
成果の意義
本研究は、世界で初めてMrgD受容体の立体構造を決定しました。MrgD受容体を含むMRGPR 構造ファミリーの構造情報は乏しく、そのリガンド認識機構や活性化機構はほとんど明らかになっておらず、MrgD選択的な薬剤の創出が困難でした。本研究により、本構造情報を活用したMrgDと選択的に相互作用できる低分子薬剤の開発が期待されます。
用語説明
注1)Gタンパク質:
グアニンヌクレオチド結合タンパク質の略称であり、GTPまたはGDPを結合して活性のON/OFFを行うことにより、細胞内情報伝達に関与する。グアニンヌクレオチドを結合するαサブユニットのほかにβ、γのサブユニットからなり「三量体Gタンパク質」と呼ばれる。大きく4つのファミリー(Gs, Gi, Gq, G12/13)に分類され、各々のGPCRは一つないし複数のGタンパク質と共役する。
注2)リガンド:
細胞膜表面に存在する受容体に対し、特異的に結合する細胞外分子である。よくリガンドと受容体は鍵と鍵穴の関係に例えられる。
注3)Gタンパク質共役型受容体(GPCR):
全タンパク質において最大のファミリーを形成する膜タンパク質群であり、共通して7つの膜貫通ヘリックスから構成される。各々が特定のリガンド認識機構を有しており、活性化されるとTM6が大きく外側に動き、細胞内のGタンパク質を結合し活性化する。哺乳類ではClass A, B, C, Fと大きく分類されMrgDはclass A GPCRに属する。
注4)β-alanine :
アミノ酸の一種であるα-アラニンの構造異性体である。2004年にShinoharaらによってMrgDの内在性アゴニストとして同定された。β-alanineはMrgDを活性化することで下流のカリウムチャネルを阻害して感覚神経細胞の興奮性を高めることが分かっている。
注5)単粒子解析法:
クライオ(極低温)電子顕微鏡を用いてタンパク質などの生体高分子を撮影し、得られた画像を解析し立体構造を再構成する手法。タンパク質試料を結晶化する必要がなく、迅速に構造決定が可能であり世界中で広く利用されている。
注6)Mas関連Gタンパク共役型受容体 (MRGPR) :
硬骨魚類から分岐した後、四肢動物が進化させた比較的新しいGPCRである。
MRGPRsは主に感覚神経や特殊な免疫細胞での発現が確認されている。その機能の多様性から、痒みと痛みの両方の調節に関与していることが知られている。
注7)MDシミュレーション :
分子の動的な構造変化を計算機で再現するために用いる手法。経験的な力場を下に、古典力学におけるニュートンの運動方程式を解き原子の時間的な配置を決定する。
注8)トグルスイッチ(W6.48) :
Class A GPCRはTM6の中心に高度に保存されたトリプトファン残基を有する。このトリプトファンはリガンドを認識し、不活性型と活性型のスイッチとして機能することが多い。
論文情報
雑誌名:Communications Biology
論文タイトル:Structural insight into the activation mechanism of MrgD with heterotrimeric Gi-protein
著者:Shota Suzuki1, Momoko Iida2, Yoko Hiroaki3,4, Kotaro Tanaka1,3, Akihiro Kawamoto5,6, Takayuki Kato5, Atsunori Oshima1,3,7
所属:
1 名古屋大学大学院創薬科学研究科
2 名古屋大学理学部生命理学科
3 名古屋大学細胞生理学研究センター
4 一般社団法人バイオ産業情報化コンソーシアム(JBIC)
5 大阪大学蛋白質研究所
6 Japan Science and Technology Agency, PRESTO
7 名古屋大学糖鎖生命コア研究所
DOI: 10.1038/s42003-022-03668-3
URL: https://www.nature.com/articles/s42003-022-03668-3
【蛋白質研究所】研究者紹介:加藤貴之教授、川本晃大助教

左:加藤 貴之教授 右:川本 晃大助教
―本研究成果の苦労された点は?―
加藤教授:GPCRは構造解析をするにはけっこう難しい蛋白質ですが、今回は名古屋大学の大嶋先生が既にスクリーニング後のサンプルを持ってこられたのでスムーズにデータ取得が終わりました。
川本助教:普通は何回かデータを撮り直しますが、2種類のサンプル測定はそれぞれ1回だけでデータ収集がスムーズに終了し、構造解析に成功しました。とてもスピーディな実験でした。
―ひと言コメントをお願いいたします―
加藤教授:良いサンプルがあれば良い結果が出ます!
川本助教:今回、非常にスムーズに出来て良かったです。






