ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- 発熱、炎症などに関与するプロスタグランジン(※1)受容体(※2)EP3シグナリング複合体の可視化 ~緑内障、高眼圧症治療薬の合理的設計に貢献~
プレスリリース
2022.09.14
発熱、炎症などに関与するプロスタグランジン(※1)受容体(※2)EP3シグナリング複合体の可視化 ~緑内障、高眼圧症治療薬の合理的設計に貢献~
発表のポイント
- ・クライオ電子顕微鏡単粒子解析※3によって活性化状態Gタンパク質※4複合体の構造を決定しました。
- ・Gタンパク質とEP3のシグナル伝達に重要なアミノ酸を特定しました。
- ・プロスタグランジン受容体EP3、EP4のGタンパク質選択に関わるアミノ酸残基を特定しました。
概要
学校法人関西医科大学(大阪府枚方市 理事長・山下敏夫、学長・友田幸一)医化学講座寿野良二講師、清水(小林)拓也教授らの研究チームは、京都大学医生物研究所杉田征彦特定助教、九州大学薬学部森本和志助教、大阪大学蛋白質研究所加藤貴之教授、髙﨑寛子助教、廣瀬未果特任研究員(常勤)らのグループと共同で、クライオ電子顕微鏡単粒子解析によってGタンパク質(Gi)結合状態の活性型プロスタグランジン受容体EP3の立体構造を決定しました。構造情報をもとにして、Gタンパク質と受容体が相互作用するアミノ酸について変異体を作製し、薬理学的解析によってシグナル伝達に重要なアミノ酸残基を明らかにしました。さらに、これまで決定されている他のプロスタグランジン受容体サブタイプ(EP2、EP4)とGタンパク質(Gs)の複合体構造と比較し、Gタンパク質と相互作用するがアミノ酸の種類が異なる部位に着目し、同様に変異体実験を行いました。その結果、Gタンパク質の種類によってシグナル伝達活性には特定のアミノ酸が必須であることを明らかにしました。
薬剤ターゲットとして知られているGタンパク質共役受容体※5(以下「GPCR」)は様々なGタンパク質を活性化させてシグナルを伝達しますが、その選択性の詳細が近年のクライオ電子顕微鏡単粒子解析によるシグナル伝達複合体の解明によって少しずつ報告されるようになってきました。しかし、様々なGPCRのGタンパク質選択性の共通原理や全貌は明らかになっていませんでした。GPCRのGタンパク質の選択性の分子機構が明らかになれば、薬剤開発に有力な情報となります。
なお、研究結果をまとめた論文が米国科学誌「Cell Reports」(インパクトファクター:9.995)に9月13日(火)付(米国東部時間)で掲載されました。
※…各専門用語の詳細は、文末「用語解説」をご参照ください。
本研究のポイント
– クライオ電子顕微鏡を用いて、炎症性発熱などに関与し、緑内障、高眼圧症治療薬のターゲットであるプロスタグランジン受容体EP3サブタイプとGタンパク質(Gi)結合状態のシグナル伝達複合体構造を可視化しました。
– 構造情報と薬理学的実験により、EP3のシグナル活性に重要なアミノ酸を明らかにしました。
– EP3と異なるGタンパク質(Gs)と他のプロスタグランジン受容体サブタイプ(EP2、EP4)とのシグナル伝達複合体構造と比較し、薬理学的実験と合わせて、Gタンパク質選択性に関わるアミノ酸を明らかにしました。
本研究の概要
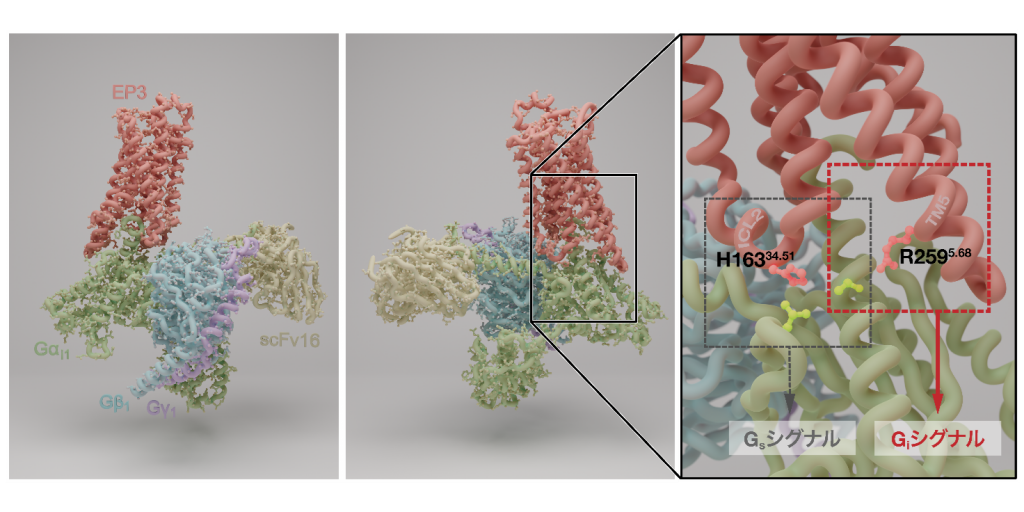
図1. プロスタグランジン受容体EP3シグナル伝達複合体の構造(PDB ID: 7WU9を一部改変)とGタンパク質選択性に関わるアミノ酸
プロスタグランジン受容体はGPCRファミリーに属し、プロスタグランジンPGE2と結合するサブタイプは4種類あります(EP1、EP2、EP3、EP4)。GPCRは大きく分けて4種類のGタンパク質(Gi/o、Gs、Gq/11、G12/13)と共役し、EP1はGq/11、EP2/EP4はGs、EP3はGi/oと共役します。
今回、寿野講師、小林教授らの研究チームは、クライオ電子顕微鏡による単粒子解析法によりプロスタグランジン受容体EP3とGタンパク質(Gi)ヘテロ三量体からなるシグナル伝達複合体の3次元構造を解明しました(図1左および中央)。構造情報をもとにしてEP3とGタンパク質の相互作用部位が明らかになり、相互作用する部位のアミノ酸変異体について薬理学的解析を行うことで、EP3のシグナル伝達に重要な部位を解明しました。また、Gsと共役するプロスタグランジン受容体サブタイプのEP2およびEP4のシグナル伝達複合体構造とEP3シグナル伝達複合体構造を比較し、対応するアミノ酸の置換変異体について薬理学的解析を行い、Gタンパク質特異的に重要なアミノ酸とその部位を見出しました(図1右)。EP2、EP3、EP4と同様に、サブタイプによってGi/oまたはGsと異なるGタンパク質に共役する他のGPCRとしてドーパミン受容体があり、そのシグナル伝達複合体でも同じ位置のアミノ酸がGタンパク質と相互作用していました。このアミノ酸によるGタンパク質選択性は様々なGPCRにも共通している可能性があることが示唆されました。
本研究の背景・意義
 GPCRは神経伝達物質やホルモンなどの様々なリガンド※6と結合して活性化すると、細胞内の様々なシグナル伝達因子を活性化することでシグナルを伝達しています。GPCRは多様な生命現象に関わっているとともに病気にも関与しており、薬剤ターゲットとして知られています。GPCRの立体構造を決定すると、リガンドの結合様式やGPCRのシグナル伝達機構を理解することができ、この情報をもとにして、より高親和性、高選択性のリガンド開発に重要な情報を提供することができます。つまり、GPCRの活性化を抑制するリガンド(拮抗薬)やGPCRを活性化するリガンド(作動薬)、シグナル選択的なリガンド(バイアス型リガンド)などの薬剤開発に大きく近づけることができます。近年のクライオ電子顕微鏡単粒子解析(Cryo-EM SPA)の高分解能化によって時間や労力が膨大に必要であったGPCRの構造解析のスピードが大きく加速したこともあり、様々な立体構造を比較することが可能になってきました。
GPCRは神経伝達物質やホルモンなどの様々なリガンド※6と結合して活性化すると、細胞内の様々なシグナル伝達因子を活性化することでシグナルを伝達しています。GPCRは多様な生命現象に関わっているとともに病気にも関与しており、薬剤ターゲットとして知られています。GPCRの立体構造を決定すると、リガンドの結合様式やGPCRのシグナル伝達機構を理解することができ、この情報をもとにして、より高親和性、高選択性のリガンド開発に重要な情報を提供することができます。つまり、GPCRの活性化を抑制するリガンド(拮抗薬)やGPCRを活性化するリガンド(作動薬)、シグナル選択的なリガンド(バイアス型リガンド)などの薬剤開発に大きく近づけることができます。近年のクライオ電子顕微鏡単粒子解析(Cryo-EM SPA)の高分解能化によって時間や労力が膨大に必要であったGPCRの構造解析のスピードが大きく加速したこともあり、様々な立体構造を比較することが可能になってきました。
成果の要点
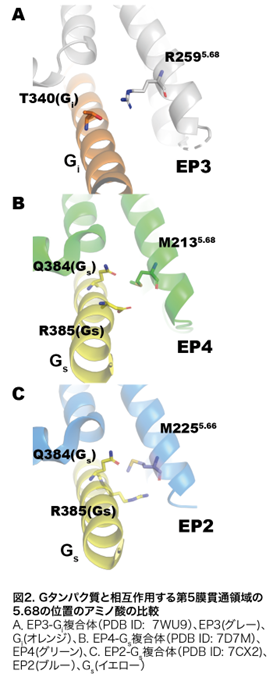
本研究の要点はプロスタグランジン受容体-Gタンパク質複合体の構造比較と薬理学的解析によって、2つのGタンパク質シグナル選択性に重要なアミノ酸を明らかにしたことです。具体的には、第5膜貫通領域(TM5)の5.68(BW番号※7)と第2細胞内ループ(ICL2)の34.51です。5.68の位置はEP3では259番目のアルギニン残基(R259)で、アルギニン残基の側鎖がGiの340番目のスレオニン残基(T340)の側鎖と水素結合していました(図2)。EP4では対応するアミノ酸は213番目のメチオニン残基(M213)でした。M213はGsの384、385番目のグルタミン、アルギニン残基(Q384、R385)と相互作用します(図2B)。EP4においてM213をアルギニンに置換した変異体M213Rは、EP4のGsシグナル活性を大きく減少しました。この理由として、構造情報を見ると5.68の位置にアルギニン残基があるとその側鎖が特にR385の側鎖と立体障害や正の電荷の反発などが生じる可能性があります。このことから5.68の位置がアルギニン残基の受容体はGsシグナルを示さず、Giシグナル活性は示せることが示唆されました(図2)。34.51の位置のアミノ酸は、Giと共役するEP3ではヒスチジン残基であり、Gsと共役するEP2、EP4ではチロシン残基でした(図3B)。EP3の34.51をチロシン残基にした変異体は本来示さないGsシグナル活性を示したことから、この位置のアミノ酸がGs共役に重要であることが示唆されました。このことはすでにマウスのEP3の実験で報告されていましたが、今回ヒトEP3において構造情報と薬理学的実験によってさらに詳細に理解することができました。34.51の芳香族アミノ酸の側鎖とGsの41番目のヒス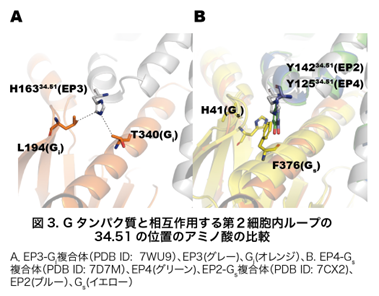 チジン残基(H41)や376番目のフェニルアラニン残基(F376)の側鎖の相互作用がGsシグナル活性に必要であることが構造情報からも明らかとなりました(図3)。
チジン残基(H41)や376番目のフェニルアラニン残基(F376)の側鎖の相互作用がGsシグナル活性に必要であることが構造情報からも明らかとなりました(図3)。
これらのGタンパク質選択性に重要なアミノ酸残基が他のGPCRにも同様の効果があるかどうかをドーパミン受容体-Gタンパク質複合体の構造情報で検討し、プロスタグランジン受容体と類似した傾向にあることがわかりました。今回我々が見出した2つのGタンパク質選択性に重要なアミノ酸は他のGPCRでも共通した役割を担っていると考えられ、Gタンパク質のシグナル伝達機構について新たな分子機構があることを示しました。
今後の展開
本研究ではプロスタグランジン受容体のGタンパク質選択性について、2つのアミノ酸が関与していることを証明しましたが、EP3は選択的スプライシング※8に由来するアイソフォーム※9が存在し、それらはGi/o以外のGタンパク質と共役することが知られています。その特徴としてはC末端の配列のみが異なるという点で、今回見出したアミノ酸とは全く異なる機構でのGタンパク質選択性の分子メカニズムが存在することが予想されます。具体的にはアイソフォームはEP3A、3B、3C、3Dなどが知られており、3AはGi/o、3Bと3CはGs、3DはGq/11といったように結合するGタンパク質が異なるので、これらの複合体構造を決定することによってEP3独自のGタンパク質選択性のメカニズムが解明されることが期待されます。また、EP3はG12/13とも共役するので、それらの複合体構造を決定することによってEP3のGi/oとのシグナル伝達機構の相違点が明らかになるとともに構造情報をもとにしてサブタイプ選択的なGタンパク質活性化を示す創薬への応用が期待されます。
なお、本研究は以下の研究事業の支援を受けて行われました。
国立研究開発法人 日本医療研究開発機構 (AMED)
・創薬等先端技術支援基盤プラットフォーム(BINDS)
国立研究開発法人 日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)
・『画期的医薬品等の創出をめざす脂質の生理活性と機能の解明』領域 (研究開発総括:横山信治)
「プロスタグランジン受容体の立体構造を基盤とした創薬開発を目指す革新的技術の創出」 (研究代表:小林拓也)
・文部科学省 科学研究費補助金研究 学術変革領域研究(B)
「マルチスケールな生理作用の因数分解基盤構築」(領域代表:斎藤毅)
「過渡的タンパク質複合体の高速構造解析プラットフォームの構築」(研究代表:寿野良二)
・日本学術振興会 科学研究費助成事業 基盤研究(B)
「バイアスリガンド開発に資するG蛋白質/アレスチン-GPCR複合体の構造解析」(研究代表:寿野良二)
用語説明
※1 プロスタグランジン:
細胞膜リン脂質からホスホリパーゼA2によって切り出されたアラキドン酸から産生される脂質メディエーター。
※2 プロスタグランジン受容体:
プロスタグランジンを受容することによって、発熱などの炎症応答、生殖、がん、ストレス応答などの様々な生理作用に関わる。
※3 クライオ電子顕微鏡単粒子解析:
電子顕微鏡を用いてタンパク質などの生体高分子の像を様々な方向から撮影し、これらの画像を重ね合わせて立体構造を3次元に再構成することにより、立体構造を決定する手法である。近年、直接検出器の技術革新などで、タンパク質の立体構造を高分解能で決定する手法が確立されてきた。2017年度のノーベル化学賞の対象となった技術。
※4 Gタンパク質:
細胞内情報伝達に関わるGTP結合タンパク質で、Gα、Gβ、Gγサブユニットの三量体を形成する。GDP結合状態は不活性な状態で、GPCRと結合することによって活性化され、Gタンパク質はGDPとGTPを交換し、その後GαとGβ-Gγの2つに解離する。解離した各サブユニットはそれぞれ異なる下流のシグナル伝達因子と相互作用して様々な生体内のシグナルを伝達する。
※5 Gタンパク質共役受容体(GPCR):
細胞の増殖や分化の制御、細胞内物質輸送など様々なものに関わっているGタンパク質(グアニンヌクレオチド結合タンパク質)と相互に反応して、細胞外の情報を細胞内へ情報伝達する受容体ファミリー。ファミリーは大きくClass A、B、Cに分類される。多くの薬の標的となっている。
※6 リガンド:
機能タンパク質と特異的に結合する物質。
※7 BW番号:
Ballesteros-Weinstein numberingと呼ばれるGPCRのアミノ酸残基の位置を指定する番号。1から7までの膜貫通ヘリックスの番号と、それぞれの膜貫通ヘリックスにおいてGPCR間で最も保存されている残基を50として表記する。例えば膜貫通領域1で最も保存されているアミノ酸の位置を1.50と表記する。その他のアミノ酸はこの保存された50の位置のアミノ酸を基準として番号を振られる。
※8 選択的スプライシング:
DNAからの転写過程において、一つの遺伝子から複数のmRNAを生成する機構のこと。
※9 アイソフォーム:
タンパク質の基本的な機能は良く似ているが、アミノ酸配列が異なっているもの。
論文情報
論文名:Structural insights into the G protein selectivity revealed by the human EP3-Gi signaling complex
著者名:Ryoji Suno1,†,*, Yukihiko Sugita2,3,4,†, Kazushi Morimoto5,†, Hiroko Takazaki2, Hirokazu Tsujimoto6, Mika Hirose2, Chiyo Suno-Ikeda1, Norimichi Nomura6, Tomoya Hino7, 8, Asuka Inoue9, Kenji Iwasaki10, Takayuki Kato2, So Iwata6, Takuya Kobayashi1,11,*
1 Department of Medical Chemistry, Kansai Medical University, Hirakata, 573-1010, Japan.
2 Institute for Protein Research, Osaka University, Suita, 565-0871, Japan.
3 Hakubi Center for Advanced Research, Kyoto University, Kyoto, 606-8501, Japan.
4 Institute for Life and Medical Sciences, Kyoto University, Kyoto, 606-8507, Japan.
5 Physical Chemistry for Life Science Laboratory, Faculty of Pharmaceutical Sciences, Kyushu University, Fukuoka, 812-8582, Japan.
6 Department of Cell Biology and Medical Chemistry, Graduate School of Medicine, Kyoto University, Konoe-cho, Yoshida, Sakyo-ku, Kyoto, 606-8501, Japan.
7 Department of Chemistry and Biotechnology, Graduate School of Engineering, Tottori University, Tottori, Japan.
8 Center for Research on Green Sustainable Chemistry, Tottori University, Tottori, Japan.
9 Graduate School of Pharmaceutical Sciences, Tohoku University, 6-3, Aoba, Aramaki, Aoba-Ku, Sendai, Miyagi 980-8578, Japan
10Life Science Center for Survival Dynamics, Tsukuba Advanced Research Alliance (TARA), University of Tsukuba, Tsukuba, Japan.
11 Japan Agency for Medical Research and Development (AMED), Core Research for Evolutional Science and Technology (CREST), 1-7-1 Otemachi, Chiyoda-ku, Tokyo 100-0004, Japan.
†These authors contributed equally
* Corresponding Author
掲載雑誌名:「Cell Reports」
公表日: 2022年9月13日(米国東部時間)
DOI: 10.1016/j.celrep.2022.111323
URL: https://www.cell.com/cell-reports/fulltext/S2211-1247(22)01147-0
【蛋白質研究所】研究者紹介:加藤 貴之教授、髙﨑 寛子助教、廣瀬 未果特任研究員(常勤)

左より:廣瀬未果特任研究員(常勤)、加藤貴之教授、髙﨑寛子助教
―本研究成果の苦労された点は?―
髙﨑助教:分子量が小さい膜タンパク質のため、解析に少々手こずりました。構造ゆらぎもあり、なかなか分解能が上がらず、その点が大変でした。
廣瀬特任研究員:当研究室で初めて委託されたGPCRでした。創薬ターゲットとして知られているGPCRの構造解析は、すごく競争の激しい分野で、そこに途中から参入する形でしたが、最初は、良いサンプルがなかなかできず大変でした。電顕のスクリーニングと寿野先生がサンプルの工夫を何度も繰り返し、ようやく安定してグリッドが作れるようになりました。
加藤教授:この研究は前任の岩崎先生の時代から進めていたプロジェクトで、髙﨑助教が担当した部分は解析が難しく、時間がかかってしまいました。
―ひと言コメントをお願いいたします―
廣瀬特任研究員:このサンプルをきっかけに寿野先生から様々なGPCRサンプルの測定依頼をいただくようになり、より創薬に関わる仕事ができて嬉しいです。
加藤教授:寿野先生がうまく論文にまとめていただけて、結果が表に出てよかったです。
髙﨑助教:また、次も任せてください!






