ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- プラス電荷を失ったリシン側鎖がつくる新規な水素結合の発見 - リシンについて教科書の常識を見直す。新たな分子間相互作用から創薬へ -
プレスリリース
2024.08.27
プラス電荷を失ったリシン側鎖がつくる新規な水素結合の発見 - リシンについて教科書の常識を見直す。新たな分子間相互作用から創薬へ -
東京薬科大学薬学部の三島正規教授、青山洋史准教授、武田光広講師、永江峰幸助教、大阪大学蛋白質研究所の宮ノ入洋平准教授、豊橋技術科学大学の広瀬侑准教授らの研究グループは、東京大学先端科学技術研究センターの石北央教授(同大学院工学系研究科兼務)、斉藤圭亮准教授、野地智康特任助教、東京都立大学大学院理学系研究科の伊藤隆教授、甲斐荘正恒名誉教授と共同で、核磁気共鳴法(NMR)(注1)やタンパク質の量子化学計算(注2)などを用いて、通常はプラス電荷を帯びると考えられているリシンの側鎖が、シアノバクテリアの光センサータンパク質の中でプラス電荷を失った状態で安定に存在すること、さらに水素結合のアクセプターとして働き、今まで知られていなかった様式の水素結合を形成していることを発見しました。リシンの側鎖がプラス電荷を帯びることは高校・大学で学習する生化学の常識です。この常識について再考を促すとともに、タンパク質の立体構造形成メカニズムの解明、タンパク質と薬などの相互作用メカニズムの解明に役立つことが期待されます。
本研究成果のポイント
- ● NMRや計算化学の手法を用いて、タンパク質中でリシン側鎖のアミノ基が通常のN+H3(電荷を持つプロトン化状態)ではなく、NH2(電荷を持たない脱プロトン化状態)で存在し、水素結合を形成していることを発見しました。
- ● さらにこの水素結合では、リシン側鎖のNH2が水素結合のアクセプターとなっていました。よく知られているN+H3の場合では水素結合のドナーとなっていることから、通常とは逆です。
- ● 今回発見した、リシンがアクセプターとしてはたらく様式の水素結合は、従来の膨大なタンパク質の立体構造研究の中で見過ごされてきた可能性があります。今回の発見は、タンパク質の立体構造形成や、薬をはじめとした多様なリガンド分子とタンパク質との相互作用の理解を深めることに貢献し、薬の開発にも役立ちます。
Ⅰ.研究の背景
水素結合は、タンパク質中において、立体構造形成、タンパク質とリガンドの結合、プロトン移動など、非常に重要な役割を果たしています。水素結合におけるドナー(供与体)と、水素結合におけるアクセプター(受容体)、そして水素原子で形成され(図1)、pKa値(注4)が高い部位(例:塩基性の官能基)がドナーとして、pKa値が低い部位(例:酸性の官能基)がアクセプターとなります(図1)。タンパク質においては、通常、リシンやアルギニンの側鎖は(注5)、プロトン化されてプラス電荷を持つことからドナーとなるとされてきました。シアノバクテリアのRcaEは、ピロール環を4つ含むフィコシアノビリン(PCB)分子を発色団として有する光センサータンパク質です。特定の波長を吸収することで緑色光吸収型と赤色光吸収型の間を変換し、それぞれ異なる立体構造を形成することが知られていました(1)(2)(3)。今回、NMRとタンパク質の量子化学計算によって、緑色光吸収型においてRcaE内部のリシンの側鎖のアミノ基が脱プロトン化してプラス電荷を失ったNH2となること、またこのNH2が水素結合のアクセプターとなり、PCBがもつNH基がドナーとなる水素結合を形成していることを明らかにしました(図2)。従来、リシン側鎖の脱プロトン化は、アセトアセテートデカルボキシラーゼや、Exiguobacterium sibiricumロドプシンで起こることが石北、斉藤らによって計算化学によって示されていましたが(4)(5)、脱プロトン化し、かつ水素結合のアクセプターとなることが実験で示されたのは、これが初めてです。

図1 水素結合
X、Yは、それぞれ電気陰性度の大きな原子(共有電子対を強く引き付ける原子)。Hは水素を示す。
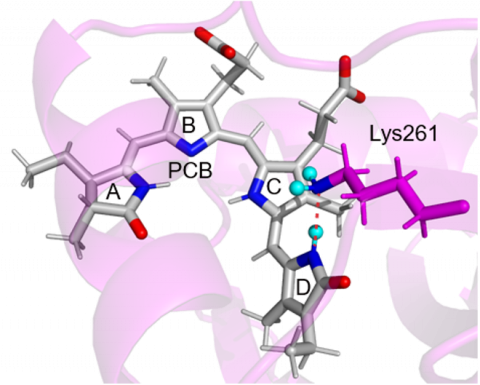
図2 リシン側鎖がNH2、アクセプターとなる新規な水素結合
タンパク質の量子化学計算によって最適化されたRcaEの構造を示す。PCBを灰色、4つのピロール環をA~Dで示す。リシン側鎖(Lys261)を濃いピンク色、水素結合を赤色の破線、水素原子はシアンの球で示す。
Ⅱ.研究の成果
まずRcaEの緑色光吸収型におけるRcaEのX線結晶構造(3)から、PCBのD環のN原子とLys261側鎖のN原子との原子間距離が3.07 Åと非常に近く、おそらく水素結合を形成していることが予想されました。通常よりも広範囲の15N核の化学シフトをカバーする1H-15N異種核単量子コヒーレンス(HSQC)NMR測定を行ったところ、緑色光吸収型において、1Hで0.69 ppm、15Nで27.4 ppmという異常に高磁場の化学シフトをもつ信号が観測されました(図3)。また各種多次元NMR実験から、この信号がLys261側鎖のアミノ基(NH2もしくはN+H3)であることが帰属できました。次に、この特異なLys261の側鎖アミノ基に由来する信号を利用して、そのプロトン化状態を解析しました。実験としては、N原子に対して何個のプロトンが共有結合しているのか決定することが可能な1Hカップル1H-15N異種核インフェーズ単量子相関(HISQC)測定を行いました。すると、信号は3本に分裂し(図4)、N原子に対して2個の水素が共有結合していることが示されました。すなわち脱プロトン化し、プラス電荷を失ったNH2状態で存在していることが明らかになりました。しかし、ここまでの実験では、このNH2が担う相互作用については分かりません。そこで、さらに水素結合相手を決定できる方法である水素結合経由のJ結合(注6)によって信号が発生するHNN相関分光法(HNN-COSY)を測定しました。この測定から、PCBのD環のNHとLys261側鎖のN原子の間のh2JNNを経由した信号を検出できたことから(図5)、D環のNH(供与体)とLys261 の側鎖のN原子(受容体)との間の水素結合の存在が直接示されました。
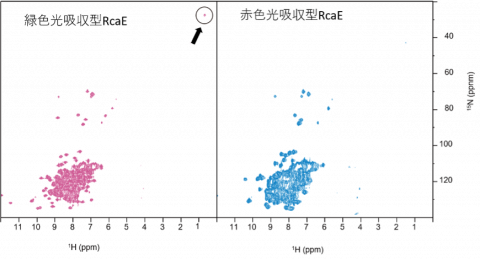
図3 1H-15N HSQC
緑色光吸収型において、1Hで0.69 ppm、15Nで27.4 ppmという異常に高磁場の化学シフトをもつ信号が観測される。黒丸で囲み矢印で示す。これがLys261の側鎖のNに由来する信号であった。
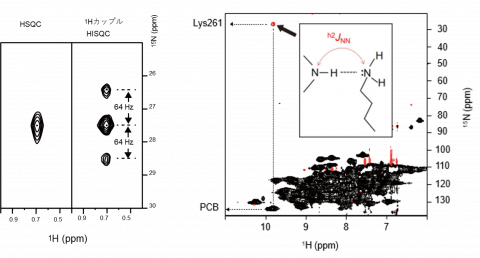
図4HSQCとHISQC
1HカップルHISQCでは、結合している水素の数によって信号が分裂する。
図5 HNN-COSY
PCBのD環のNH基と、Lys261のN原子の間に信号(交差ピーク、赤)がはっきりと観測されている。これは水素結合の存在を示しており、また、そのドナーとアクセプターを一義的に決定できる。
また、タンパク質の量子化学計算によって得られたNH2状態のLys261側鎖の15Nの化学シフトは26.4 ppmで、実験的で得られた値27.4 ppmとよく一致しました。一方、計算で得られたN+H3状態の化学シフトは34.3 ppmであり、NH2状態の計算および測定された化学シフトとは明確に異なりました。脱プロトン化したLys261のN原子とD環のNH基の間の水素結合のポテンシャルエネルギープロファイルは、プロトンが主にD環部分に局在していることを示していました。すなわち、緑色光吸収型のタンパク質環境でのD環のpKa値はLys261のpKa値よりも高いことが示されており、Lys261のN原子は量子化学計算による最適化構造では脱プロトン化されたままでした。このように計算結果は、リシン側鎖が脱プロトン化し、アクセプターとなる水素結合の存在を支持するものでした。
Ⅲ.今後の展開
今回発見したリシンがアクセプターとなる水素結合の形成は、タンパク質内部の環境が非常に疎水的でリシン側鎖の脱プロトン化を促進していることが一因と考えられます。したがって、疎水性が強い環境においては、従来知られていた水素結合とは異なる未知の相互作用がタンパク質内部、あるいはタンパク質とリガンドとの分子間相互作用として用いられている可能性があります。従来の膨大なタンパク質の立体構造研究のデータの中で見過ごされてきた可能性も含め、RcaE以外のタンパク質でも実際にこのような水素結合が形成されるのか、丹念に調査する必要があります。そのような研究は、タンパク質の立体構造形成や、薬を含む多様なリガンド分子とタンパク質との相互作用の理解に貢献し、将来の薬の開発にも役立ちます。
参考文献
(1) Y. Hirose et al., Green/red cyanobacteriochromes regulate complementary chromatic acclimation via a protochromic photocycle. Proc Natl Acad Sci U S A 110, 4974-4979 (2013).
(2) T. Nagae et al., Structural basis of the protochromic green/red photocycle of the chromatic acclimation sensor RcaE. Proc Natl Acad Sci USA 118 e2024583118 (2021).
(3) T. Nagae et al., Green/red light-sensing mechanism in the chromatic acclimation photosensor. Sci Adv 10, eadn8386 (2024).
(4) H. Ishikita, Origin of the pKa shift of the catalytic lysine in acetoacetate decarboxylase. FEBS Lett 584, 3464-3468 (2010).
(5) T. Noji, Y. Chiba, K. Saito, H. Ishikita, Energetics of the H-Bond Network in Exiguobacterium sibiricum Rhodopsin. Biochemistry 10.1021/acs.biochem.4c00182 (2024).
Ⅳ.研究成果の公表
本研究成果は、科学誌「Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)」に2024年8月26日の週に掲載されます(報道解禁日2024年8月26日午後 3 時 (米国東部時間))。
論文タイトル:Direct evidence for a deprotonated lysine serving as a “H-bond acceptor” in a photoreceptor protein
著者:Takayuki Nagae, Mitsuhiro Takeda, Tomoyasu Noji, Keisuke Saito, Hiroshi Aoyama, Yohei Miyanoiri, Yutaka Ito, Masatsune Kainosho, Yuu Hirose, Hiroshi Ishikita*, Masaki Mishima* (*correspondence)
Ⅵ.謝辞
本研究は、文部科学省科学研究費助成事業「JP22H02562、JP24H02094(三島); JP23H04963、JP24K01986(斉藤);JP20H03217 、JP23H02444(石北)」の支援を受けて行われました。X線結晶構造解析は、あいちシンクロトロン光センターBL2S1(2021N6003)、NMR測定は、蛋白質研究所共同研究員・超高磁場NMR利用課題(NMRCR-18-05、-19-05、-20-05)および理研NMRプラットホーム(JPMXS0450100021)、計算は筑波大学計算科学研究センターの学際共同利用プログラムの支援を受けて行われました。
【用語解説】
- (注1)核磁気分光法(NMR)
2002年にノーベル化学賞が授与された分子構造を解析する手法。結晶化や急速凍結を必要とせず、溶液中、水溶液中での分子の構造を解析できる。X線結晶構造解析では困難なタンパク質中の水素の情報を得る事ができる。 - (注2)タンパク質の量子化学計算
本研究では特にQuantum Mechanics/ Molecular Mechanics(QM/MM) 法を用いた。計算精度を持ち合わせた量子力学計算(QM)と計算速度を持ち合わせた分子力学計算(MM)を組み合わせることで、巨大分子を実用的な精度・速度で計算することができる。2013年ノーベル化学賞受賞者A. Warshel教授、M. Levitt教授らにより開発された。 - (注3)プロトン
水素イオン(H+)をプロトンと呼ぶ。水素イオンが結合してプラス電荷をもっている状態をプロトン化状態、水素イオンが結合しておらずプラス電荷を持っていない状態を脱プロトン化状態と呼ぶ。 - (注4)pKa
分子の半数がプロトン化状態になるpH。酸となる官能基はpKaの値が低く、塩基となる官能基はpKaの値が高い。 - (注5)塩基性アミノ酸
リシンとアルギニンの側鎖のN(窒素)原子は、通常プロトン化し、プラス電荷をもつことが知られている。 - (注6)J結合
NMRにおいて共有結合を介して原子核どうしがお互いに変調を起こす相互作用。有機化学では信号の分裂として観測し、分子構造の解析に用いられる。共有結合だけでなく、水素結合を介したJ結合も存在することが知れられており、hJのように示す。h2JNNの記載は、水素結合を介して全体で結合を2本経由しており、NとNの間に生じるJ結合を表す。
研究者からひと言
これまでの研究では、リシン残基側鎖のアミノ基がNH2となっている状態は人工的に作り出されたものを対象に、その特性などが調べられていました。今回の研究により、天然の蛋白質中でもNH2状態が確認され、NMR解析により、その機能まで明らかにすることができました。
今後、リシン残基側鎖との相互作用を介した新たな薬剤の設計等に役立つことが期待されます。
高磁場NMR分光学研究室(宮ノ入研)
http://www.protein.osaka-u.ac.jp/rcsfp/apc/nmr/






