ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- コレラ菌の生存に必須である呼吸鎖酵素の構造を解明 −病原性細菌に対する新しい抗菌剤の開発研究へ貢献−
プレスリリース
2022.07.27
コレラ菌の生存に必須である呼吸鎖酵素の構造を解明 −病原性細菌に対する新しい抗菌剤の開発研究へ貢献−
概要
先進国ではコレラはもはや深刻な感染症ではありませんが、途上国では地域的流行(エンデミック)が散発しており、依然として深刻な感染症です。また世界的に見ても、抗菌剤の効かない薬剤耐性菌の出現は大きな社会問題となっています。新しい創薬標的や抗菌剤の候補化合物を継続して探索することは、非常に重要な作業です。
京都大学大学院農学研究科の石川萌 博士課程学生、三芳秀人 同教授、大阪大学蛋白質研究所の岸川淳一 助教らは、レンセラー工科大学(米・ニューヨーク州)との国際共同研究によって、コレラ菌など一部の病原性細菌のエネルギー生産に必須の呼吸鎖酵素(ナトリウム輸送性NADH-ユビキノン酸化還元酵素※1、以下NQRと略す)の詳細な構造を、低温電子顕微鏡法(クライオ-EM法)※2を用いて初めて明らかにしました。加えて、異なる2種類の阻害剤がNQRに結合している状態の構造も明らかにしました。今回の成果によって、NQRを標的とする新しい抗菌剤の開発研究の進展が期待されます。
本研究成果は2022年7月26日(現地時刻)に国際学術誌「Nature Communications」にオンライン掲載されます。
本研究の概念図(作:石川萌)
1.背景
ナトリウム輸送性NADH-ユビキノン酸化還元酵素(NQR)は、細菌の細胞膜に存在する呼吸鎖酵素で、1977年にコレラ菌で初めて発見されました。その後、一部の病原性細菌や海洋性細菌でも発見され、現在では約100種類の細菌でその存在が知られています。NQRは細胞膜を介してナトリウムイオンを能動輸送し、ナトリウムイオンの濃度勾配を形成します。このナトリウムイオンの濃度勾配は、生物のエネルギーの“素”であるATPという化学物質の生産や、鞭毛運動の駆動力としてはたらくため、細菌の生存には欠かせません。このことから、NQRを阻害する化合物は細菌のエネルギー代謝全般を遮断するため、有望な抗菌剤として期待されます。
従来の抗菌剤の標的は、細菌に特有のタンパク質合成系、DNA複製系、細胞壁合成系の“三大標的”に偏り過ぎており、このことが薬剤耐性問題の主な原因だとする見解があります。これを考慮する時、従来の三大標的の範疇ではなく、エネルギー代謝の重要酵素であるNQRを標的とすることによって、薬剤耐性問題を克服する新たな可能性が期待できます。
NQRの研究を進展させるに当たって、基質のユビキノンや阻害剤が酵素のどこに結合しているかを明らかにすることは必須です。2014年にドイツの研究グループがコレラ菌NQRのX線結晶構造をNature誌に初めて発表しました。残念ながら、この構造ではユビキノンも阻害剤も結合していなかったため、酵素内部でどのような反応が進行するのかは謎のままでした。加えて、NQRの約10%に相当する部分の構造は解かれていませんでした。このような背景から、NQRの詳細な全体構造の解明が待望されてきましたが、その後8年間も構造に関する研究の進展がありませんでした。その理由として、NQRのような膜タンパク質のX線結晶構造解析は非常に困難であることが挙げられますので、これまでとは異なる研究手法によってNQRの構造を明らかにする必要がありました。
|
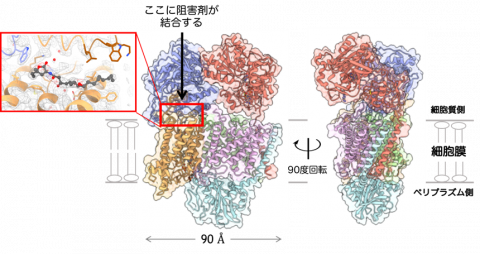
図1. クライオ-EM法によって明らかになったコレラ菌NQRの立体構造。 NQRはNqrA~Fの6つのサブユニットで構成される(図中ではそれぞれ色分けした)。 阻害剤はNqrBサブユニット(黄色)の細胞質側に結合することが判明した。 |
2.研究手法・成果
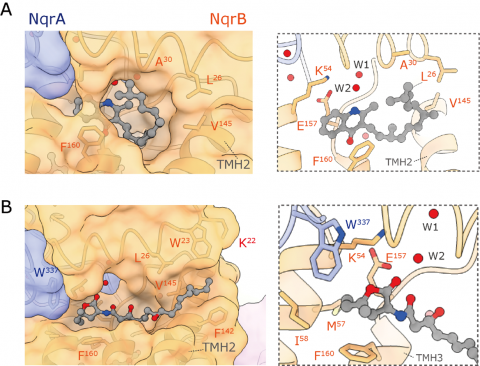
本研究では、大阪大学蛋白質研究所に設置されている低温電子顕微鏡(Titan Krios)を用いて、コレラ菌NQRの全構造を世界で初めて明らかにしました(図1)。これにより、酵素内を移動する電子の経路が全て明らかになりました。さらに、コロルミシン※3とオーラシン※3という2つの異なる系列の阻害剤がそれぞれ結合している状態の構造解明にも成功しました。興味深いことに、コロルミシンとオーラシンとでは結合ポケットの構造が微妙に違っていました(図2)。この事実は、NQRと阻害剤の結合様式は、一般的に「鍵と鍵穴」式のモデルで示されるような厳密で一様なものではなく、阻害剤の構造に応じて酵素が柔軟に変形して阻害剤を包み込むことができることを示唆しています。例えば、いろいろな形のものを風呂敷で包むようなイメージでしょうか。このような結合様式は極めて珍しいケースであり、今後の抗菌剤シーズ化合物の分子設計にとって貴重な情報になるでしょう。
|
図2. オーラシン (A)とコロルミシン (B)が結合した状態のNQRの構造。 両者を比べると、阻害剤を取り囲むアミノ酸残基の配置が変化して、阻害剤を収容するポケットの構造が違っていることがわかります。 |
3.波及効果、今後の予定
本研究を通じて、NQRを標的とする抗菌剤開発を進めるための基盤を確立することができました。病原性細菌による食中毒などが時々報道されますが、もはや日本ではコレラは深刻な感染症ではありません。しかし、発展途上国では地域的流行(エンデミック)が散発しており、依然として深刻な感染症です。ジョンズ・ポプキンス大学のアリ博士らによる調査(2008〜2012年)に寄れば、世界で年間平均290万人が感染し、死者は平均9.5万人に及びます。病原性細菌における薬剤耐性が大きな社会問題になっている現在、新しい標的を見つけ、その標的に作用する抗菌剤の創薬基盤を整備しておくことの意義は大きいものと考えます。
今回明らかにしたNQRの構造は、本酵素がはたらいている一連の連続的な構造変化の1コマの姿でしかありません。今後は、酵素がはたらいている過程で連続的に変化する姿をクライオ-EM法で浮き彫りにし、NQRのはたらくメカニズムの全貌を明らかにする予定です。
※全てのコレラ菌が病原性毒素(コレラ毒素タンパク質)を生産するわけではなく、一部の毒素生産型コレラ菌に限られます。
4.研究プロジェクトについて
本研究は、科学研究費補助金(21H02130、22K14837)、特別研究員奨励費(22J10185)および京都大学運営費の支援を受けました。
用語解説
※1 ナトリウム輸送性NADH-ユビキノン酸化還元酵素(NQR):
細菌の細胞膜に存在し、基質であるNADHとユビキノンの酸化還元を駆動力として、ナトリウムイオンを細胞膜の外側へ能動輸送する酵素です。哺乳類ミトコンドリア には、ナトリウムイオン(Na+)の代わりにプロトン(H+)を輸送する酵素(呼吸鎖複合体-I)が存在しますが、進化的にも構造的にもNQRとは異なるため、NQRは理想的な創薬標的だと考えられています。
※2 低温電子顕微鏡法(クライオ-EM法):
タンパク質などの生体高分子を生理的環境に近い水溶液中で凍結させた状態で電子顕微鏡観察する手法。構造生物学の分野では、従来のX線結晶構造解析法に代わるタンパク質の構造解析法として急速に発展しています。
※3 コロルミシン、オーラシン:
NQRの反応を阻害する化合物(小さな分子)であり、コロルミシンは海洋性細菌から、オーラシンは放線菌からそれぞれ発見された化合物です。構造的な共通点が乏しいにも関わらず、2つの化合物はともに極めて低い濃度でNQRを阻害するため、有望な抗菌剤のシーズ化合物となることが期待されます。
研究者のコメント
私たちはNQRのはたらく仕組みを明らかにするべく、米国の研究グループと10年近く共同研究を続けてきました。今回、NQRの詳細な全体構造だけでなく、コロルミシンやオーラシンが結合した状態の構造まで一挙に明らかにすることができ、喜びは2倍です。私たちは基礎研究が中心ですが、創薬研究に貢献できるような知見を提供すべく、これからも地道に研究成果を積み上げていきたいと思っています。(三芳秀人)
論文情報
タイトル:Cryo-EM structures of Na+-pumping NADH-ubiquinone oxidoreductase from Vibrio cholerae
(コレラ菌Na+輸送型NADH-ユビキノン酸化還元酵素のクライオ-EM構造)
著 者: 岸川淳一1*、石川萌2*、桝谷貴洋2、村井正俊2、北隅優希2、Nicole Butler3、加藤貴之1、Blanca Barquera3、三芳秀人2#(*同等筆頭著者、#責任著者)
[所属:1)大阪大学蛋白質研究所、2)京都大学農学研究科、3)レンセラー工科大学生物科学部]
掲 載 誌:Nature Communications DOI:10.1038/s41467-022-31718-1
【蛋白質研究所】研究者紹介:岸川 淳一助教

岸川 淳一助教
―本研究成果の苦労された点は?―
今回の蛋白質は柔軟でぶらぶらと動くもので、構造解析の手法的には非常にやりづらいものでしたが、それを構造の違いから上手く分類してそれぞれの構造を明らかにするというところに、少し一工夫がいった点だったと思います。
―ひと言コメントをお願いいたします―
コレラ菌のように、まさしく病原菌に関わる研究は初めてだったので、今回、得られた構造が薬や創薬に繋がると嬉しいです。






