ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- シアノバクテリアの光スイッチの「かたち」を解明 ~新たな光遺伝学ツールの開発や光合成機能の解明へ~
プレスリリース
2021.05.11
シアノバクテリアの光スイッチの「かたち」を解明 ~新たな光遺伝学ツールの開発や光合成機能の解明へ~
- ■研究の背景
- ある種のシアノバクテリアは、赤色光と緑色光のバランスを感知して効率よく光合成を行います。この“光の色”を感知するセンサーとして機能するのが、ビリンとよばれる色素分子をもつ光スイッチタンパク質です。この光スイッチは光遺伝学のツールとして応用されていますが、その分子構造は明らかにされていませんでした。
- ■研究の成果
- シアノバクテリアの光スイッチタンパク質であるRcaEの分子構造を解明しました。RcaEの赤色光吸収型のX線結晶構造を高精度で決定し、ユニークな「穴開きバケツ」構造を発見しました。計算科学的手法によりタンパク質内部構造や水分子のダイナミクスを明らかにしました。また核磁気共鳴分光法(NMR)によって、緑色光吸収型においてビリン発色団の水素イオンの脱離が起こっていることを実証しました。これらの複合的な解析アプローチにより、穴開きバケツ構造は水素イオンの通り道として機能している可能性が示唆されました。
- ■今後の展望
- 本研究で明らかにした構造は、新しい細胞や生体の観察技術の開発や光遺伝学ツールの創出につながり、将来の医薬品開発に貢献します。シアノバクテリアの有する新しい光合成機能の解明も期待できます。
概 要
東京薬科大学・薬学部・分子生物物理学教室の三島正規教授らのグループは、豊橋技術科学大学・大学院工学系研究科・広瀬侑助教、名古屋大学・シンクロトロン光研究センター・永江峰幸助教、佐賀大学・理工学部・海野雅司教授、大阪大学蛋白質研究所・宮ノ入洋平准教授、東京都立大学・大学院理学研究科・伊藤隆教授、宮崎大学・医学部・和田啓准教授らのグループとの共同研究により、シアノバクテリアの光スイッチタンパク質であるRcaEの分子構造を、X線結晶構造解析、分子動力学計算、およびNMRによって解明しました。
背 景
シアノバクテリアは光合成を行う原核生物であり、地球上の様々な環境に生息することが知られています。ある種のシアノバクテリアは、赤色光と緑色光のバランスを感知して効率よく光合成を行う「補色順化」と呼ばれる能力を持ちます。補色順化において、光色を感知するセンサーとして機能するのが光スイッチタンパク質RcaEです。これまでの研究で、RcaEはビリン発色団を結合して緑色光吸収型と赤色光吸収型の間を光変換することや、その光変換にはビリン発色団の異性化や水素イオン(プロトン)の脱着反応によって駆動されることが示唆されていました。またこれらの光スイッチは遺伝子発現を制御するための優れたツールとして光遺伝学においても利用されています。ところが、光反応を説明する分子構造は明らかにされていませんでした。
成 果
私達のグループは、あいちシンクロトロン光センターの名古屋大学ビームラインを用いてRcaEの赤色光吸収型の高分解能(1.63Å)の構造解析に成功しました。RcaEのビリン発色団の4つのピロール環(A-D環)の構造は、D環のみが外側を向いた構造(C15-E,syn型)で、過去の光スイッチでは報告例のない構造でした(図1)。

今回の研究で得られた構造情報と、過去のアミノ酸置換変異実験との比較から、ビリン発色団と相互作用するアミノ酸残基の役割を理解することができました。今回の構造において予想外だったのは、RcaEのビリン発色団を格納するタンパク質ポケットに大きな「空隙」が存在したことです。ビリン発色団は、酸性アミノ酸残基を介して、空隙内部のクラスター化した水和水と水素結合を形成していました(図2)。分子動力学計算によって、それらの水和水が溶媒の水と素早く入れ替わることも示されました。このようなビリン発色団と溶媒水分子をつなぐ空隙は、これまでに発見された光スイッチタンパク質において見つかっていません。我々は、RcaEの持つこの特徴的な構造を「穴あきバケツ(Leaky bucket)」構造と名付けました(図2)。この穴開きバケツ構造がRcaEの光変換反応におけるプロトンの通り道として機能しているのではないかと考えられました。
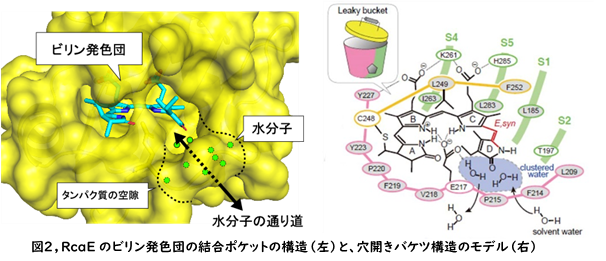
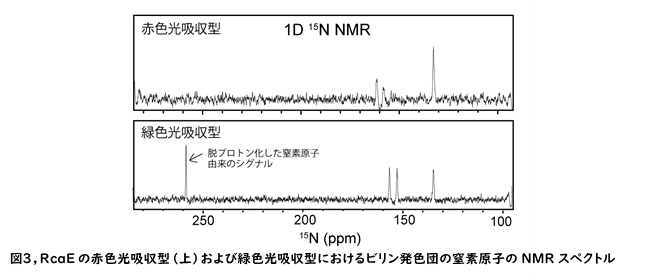
RcaEの緑色光吸収型と赤色光吸収型の光変換では、ビリン発色団のプロトン化状態が変化することが、これまでの研究で示唆されていました。我々は、RcaEのビリン発色団のプロトン化状態を直接的に検出するため、NMRを利用しました。赤色光吸収型では4つのピロール環にプロトンが結合した窒素原子の信号が得られましたが、緑色光吸収型においては1つのプロトンが外れた窒素原子の信号が観測されました(図3)。量子化学計算から、この脱プロトン化はビリン発色団のB環で起こることが示唆されました。これらの結果は、RcaEのプロトン脱着反応を介した吸収波長の制御機構の解明に大きく貢献します。
展 望
今回明らかにしたRcaEの構造は、ビリン発色団の多様な吸収波長を生み出すメカニズムの物理化学的理解に大きく貢献できます。さらにこの知見は、細胞生物学や医薬品開発に役立つ光遺伝学ツールの開発に繋がることが期待されます。
論文情報
Nagae T., Unno M., Koizumi T., Miyanoiri Y., Fujisawa T., Masui K., Kamo T., Wada K., Eki T., Ito Y., Hirose Y., and Mishima M. Structural basis of the protochromic green/red photocycle of the chromatic acclimation sensor RcaE. Proc. Natl. Acad. Sci. U.S.A. (2021) in press.
■研究に関するお問い合わせ先
大阪大学 蛋白質研究所 高磁場NMR分光学研究室 准教授 宮ノ入 洋平
TEL: 06-6105-6078 mail: y-miyanoiri[at]protein.osaka-u.ac.jp






