ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- —極小(10万分の1ミリメートル)サイズの回転分子モータータンパク質の回転をクライオ電子顕微鏡で捉えた。回転分子モータータンパク質の仕組みを解明—
プレスリリース
2022.03.28
—極小(10万分の1ミリメートル)サイズの回転分子モータータンパク質の回転をクライオ電子顕微鏡で捉えた。回転分子モータータンパク質の仕組みを解明—
京都産業大学の横山謙教授、大阪大学蛋白質研究所の岸川淳一助教らのグループは、クライオ電子顕微鏡を用いた構造スナップショット解析により、回転分子モータータンパク質であるV-ATPaseの回転機構を明らかにしました。この研究成果は、Nature Communications電子版に掲載されました。
概要
生命には回転することで働く回転分子モータータンパク質が存在します。生命のエネルギー通貨である ATP(アデノシン三リン酸)の生産や、イオンの輸送を通して細胞の恒常性を支える重要な膜タンパク質です。1mm のさらに十万分の1の大きさしかありませんが、ATPを使って回転軸を1秒間に100〜500回転させます。私達の体の中では、この回転分子モータータンパク質の働きにより、自分の体重と同じ重さの ATPが毎日作られています。
本研究グループ(代表:京都産業大学生命科学部 横山謙教授)は、回転分子モータータンパク質である V/A-ATPaseが回転する様子を、クライオ電子顕微鏡により撮影(スナップショット)することに成功しました。スナップショットをつなぎ合わせることで、V/A-ATPaseの回転を再現し、ATPを燃料として回転する仕組みを明らかにしました。今まで提唱されてきたモデルを書き換え、自然が作り出した驚異的な分子機械の仕組みを知ることができました。
同じ方法で、他のタンパク質の仕組みを解明することが可能であり、今回の研究は、新しいタンパク質研究の世界を切り開く先駆けになります。
本研究成果は、2022年3月8日に英国科学雑誌 Nature Communications (Nature Publishing Group 発刊) に掲載されました。
背景
バクテリアから私たち人間まで、全ての生命の活動には、ATP(アデノシン三リン酸)と呼ばれる共通のエネルギー通貨が使われています。ATP合成酵素は、食物などから得られたエネルギーを用いて、このATPを作り出す膜タンパク質で、F型とV型(V/A-ATPase)などに分類されます。ほぼあらゆる生命活動にATPが必要とされるので、 私達の体にある ATP合成酵素は、自分の体重と同じかそれ以上の ATPを毎日作り出しており、体の中で最も働き者のタンパク質であると言えます。
V/A-ATPaseのATPを作り出す部分は、V1とよばれ、ATPを分解する部位(触媒部位)を3つ持つ中空のシリンダー構造と、中心の軸タンパク質からなり、軸が回転することで効率よく ATPを作り出します(図1)。反対にATPを加水分解して回転すると、膜に埋まったVo部分で水素イオンを輸送します。ATPの合成と加水分解は裏表の反応で、ATPの分解反応を知ることは、ATPの合成機構を知ることになります。そのため、多くの研究者が ATPによる回転機構の解明に取り組んできましたが、その全容解明に至りませんでした。
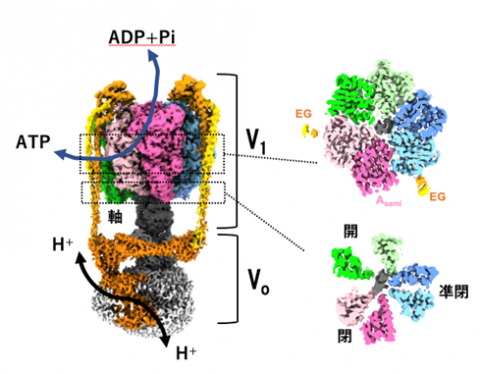
図1
左:V/A-ATPase の構造を横から見たもの。ATPが V1部分で分解されると中心回転軸が回転し、Vo部分でプロトンが輸送される。
右:上から見た断面図。点線で囲った範囲を反映。
結果
横山教授、岸川助教(大阪大学蛋白質研究所)、中西 温子研究員、中野 敦樹(修士2年)、佐伯 詩織(修士2年)らのグループは、最近目覚ましい発展をとげているクライオ電子顕微鏡により、回転分子モータータンパク質である V/A-ATPaseの回転しているときの様子を撮影(スナップショット)することに成功しました。従来の方法では、止まっているときのタンパク質の形を見ることになりますが、今回の研究では、動いているときのタンパク質を急速凍結することで様々な回転段階にある V/A-ATPase のスナップショットを撮影することができました。回転運動のコマ撮りであるスナップショットをつなぎ合わせることで、ATPの加水分解エネルギーにより軸が回転する仕組みを説明する新しい概念のモデルが導き出されました(図2)。
回転分子モータータンパク質の回転の駆動力の源泉について、これまでのモデルは、「ATPの結合が軸タンパク質を回転させる直接の駆動力になっている(binding zipperモデル)」としてきました。これに対し、私たちは今回の研究で、次のような①〜③のプロセスが同時に起こることで軸タンパク質が一方向に回転することを明らかにしました。
① ATPの結合が直接軸タンパク質を回転させるわけではなく、結合したATPによって〈開〉から〈凖閉〉へ自発的に構造が変化する。
② ATPが結合した〈凖閉〉状態で、ATPが加水分解されてADP+Piとなると、構造が〈閉〉へと変化する(このとき、ATPが結合した〈凖閉〉と、分解された状態にあるADP+Piが結合した〈閉〉との間には自由エネルギー差があり、自発過程になる。①と②の自発過程が軸の120°回転の推進力となる)。
③ 軸の回転により〈閉〉が〈開〉になることでADP+Piが放出される。
このように、3つの触媒部位で、ATP加水分解の反応過程が別々かつ同時に起こり、それぞれの反応が軸タンパク質の回転と厳密に協同しています(図2)。
今回の研究成果により、「2つの触媒部位間でのATP加水分解反応の自由エネルギー差が、軸タンパク質の回転を推進する。」ことが明らかになりました。このように精緻で巧妙な仕組みでATP合成酵素が機能し、軸の回転によりATPが効率良く作りだされる自然の仕組みは、大変な驚異でもあります。
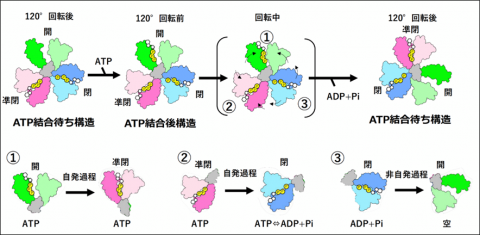
図2
ATP結合待ち構造の触媒部位(空)にATPが結合してATP結合後構造になる。①結合したATPによる開から凖閉への構造変化、②ATPが結合した凖閉からATPが加水分解される状態にある閉への構造変化、③ADPとPiが結合した閉が軸の回転により開になることでADPとPiが放出される。②は、ATPが結合した凖閉と、分解される状態にあるATPが結合した閉との間に、結合したATPの状態による自由エネルギー差があり、自発過程になる。①〜③の進行と軸の120˚回転が協同することで、1分子のATPが分解されATP結合待ち構造に戻る。
今後の展開
今回の研究で、V1部分において、どのように ATPが効率良く生産されるのか、という疑問に答えることができました。膜内在部分 Vo での水素イオンの流れによる回転機構は明らかになっていませんが、クライオ電顕によるスナップショット撮影により解明することが次の課題になります。ATPの分解やイオンの流れを回転運動に変える分子機械は、まさに自然が作り出した驚異の造形物であり、現在の私たちの知識や技術では、到底真似することはできません。その動作原理の解明は、生命の根源を支えるミクロな世界での営みを知ることになり、その知識の蓄積は生命の原理を理解することに繋がります。
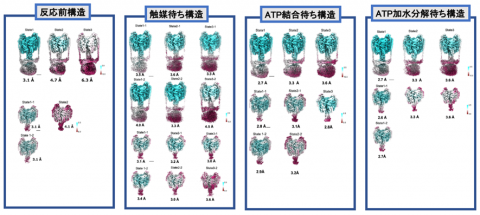
参考図 今回の研究で決定された V/A-ATPase の構造。33 種類の構造から 18の原子モデルを構築した。それぞれの構造を解釈することで、図2の回転機構モデルに至る。
用語・事項の解説
1. V/A-ATPase: 真核生物の V-ATPase の祖先型 ATPase で、古細菌(Archea)や細菌に存在することから 細菌型 V-ATPase もしくは V/A-ATPase と呼ばれる。V-ATPaseは細胞にある小胞の酸性化を通して、タンパク質の分解や免疫反応、栄養代謝などを支えているプロトンポンプタンパク質。
2. 自発過程:エネルギーが大きな状態と小さな状態間で行き来できる場合、外界にエネルギーを放出してエネルギーの小さな状態に自然と進行すること。ATPが加水分解するとエネルギーを外界に放出するので、自発過程になる。
3. クライオ電子顕微鏡:凍結した試料を観察する電子顕微鏡のこと。凍結したタンパク質試料を電子により見ることができる。場合によってはタンパク質をつくる原子一つ一つを直接見ることも可能。
論文情報
■論文タイトル
「Structural snapshots of V/A-ATPase reveal the rotary catalytic mechanism of rotary ATPases」
(V/A-ATPase の構造スナップショットにより回転ATPaseの回転触媒機構を解明)
■掲載誌
英国科学雑誌「Nature Communications」(オンライン版)
■掲載日
2022年3月8日(火)19:00(日本時間)
■著者
岸川淳一1、中西温子1、中野敦樹1、佐伯詩織、古田綾、加藤貴之、光岡薫、横山謙2
(1筆頭著者、2責任著者)
doi: 10.1038/s41467-022-28832-5
謝辞
本研究は、科学研究費補助金(基盤研究(B))20H03231、20K06514、武田特定研究(武田財団)、京都産業大学 タンパク質動態研究所、感染分子研究センター、AMEDの創薬・生命科学研究支援プラットフォーム事業(BINDS)(助成番号1312)、文部科学省「ナノテクノロジープラットフォーム」の支援により行われました。






