ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- 遂に解明!精子に必須のタンパク質VSPのメカニズム~電気信号は化学信号にどのように変換されるのか?
プレスリリース
2022.06.27
遂に解明!精子に必須のタンパク質VSPのメカニズム~電気信号は化学信号にどのように変換されるのか?
【研究成果のポイント】
●精子の機能に 必須の タンパク質、電位依存性ホスファターゼ( VSP )※1 が 生体の 電気信号を 化学信号(酵素のはたらきに単一の分子内で変換するメカニズムを解明
●蛍光色素を用いることで、電気信号を感知する部位と酵素部位の直接的な相互作用の検出に成功
● 電気信号を利用して新たな化学信号を生み出す新規分子ツールの開発に期待
 概要
概要
大阪大学大学院医学系研究科の大学院生水谷夏希さん(博士課程)、岡村康司教授(統合生理学)と蛋白質研究所の中川敦史教授(超分子構造解析学)らの共同研究グループは、精子の機能に必須の電位依存性ホスファターゼ( VSP )というタンパク質分子において電気信号(細胞膜の電位変化)が化学信号( 酵素のはたらきに変換されるメカニズムを明らかにしました。
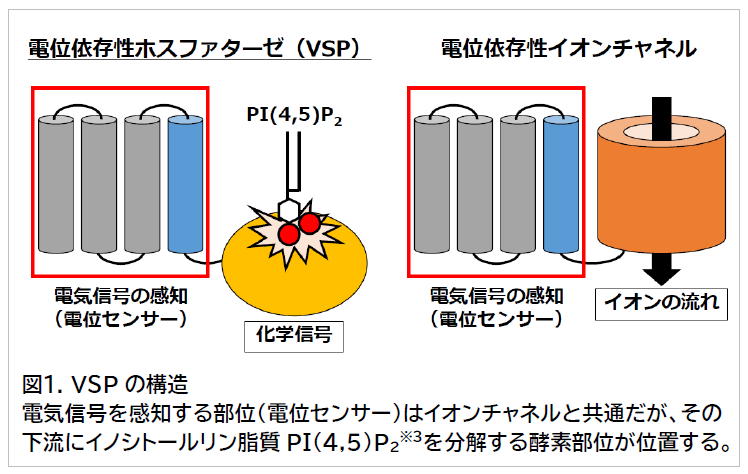
これまで生体では、電気信号は電位依存性イオンチャネル※2というタンパク質分子 (図1右)が複数集まることでイオンの流れに変換され、これが記憶や行動といった複雑な機能の実現に重要であることが知られてきました。一方、2005 年に岡村教授らによって発見されたVSPは単一の分子内で電気信号をイオンの流れではなく酵素のはたらきという化学信号に変換するユニークな分子であり(図1 左 、精子の運動 制御に重要な役割を果たしていることが報告されてきました。しかしながら、どのようにして電気信号が化学信号に変換されるのかについては解明されていませんでした。
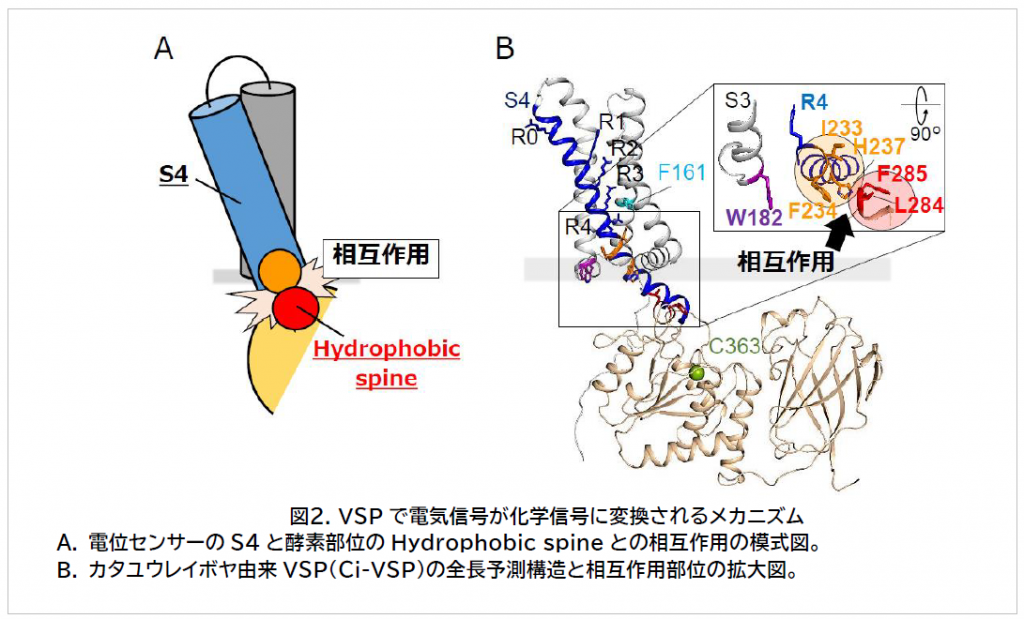
今回、岡村教授らの研究グループは 、Anap [3 -(6-acetylnaphthalen-2-ylamino) -2-aminopropanoic acid] という蛍光を発する人工アミノ酸を VSPの内部に組み込み、その蛍光強度の変化を検出しました。これにより、電気信号を感知する部位(電位センサー)と酵素部位が直接相互作用することを発見し、これが電気信号を化学信号に変換するエッセンスであることを解明しました(図2A) 。これにより、VSPの電位センサーと別種の酵素を繋げることで 全く新しい電気化学信号変換ツールの開発 につながることが期待されます。
本研究成果は、米国科学誌「米国科学アカデミー紀要( Proceedings of the National Academy of Sciences of the United States of America 、PNAS) 」に、 6月21日(火)5 時(日本時間)に公開されました 。
研究の背景
人間をはじめとする生物は、電気信号(細胞膜の電位変化)を巧みに利用することで考えたり行動したりしています。例えば私たちが手を動かしたいと思ったとき、脳から出された信号 は神経を通って高速で手の筋肉に伝達されますが、その際一つ一つの神経細胞の表面(細胞膜)に存在する電位依存性 イオンチャネルというタンパク質分子が重要な役割を担っています。電位依存性イオンチャネルは、電気信号を感知する部位(電位センサー)とナトリウムイオンやカリウムイオンなど特定のイオンの通り道から構成されるユニットが複数集まって、信号に応答してイオンの流れを制御します。古くから、生体の電気信号はイオンの流れを制御していると考えられてきました。
岡村教授らの研究グループは、イオンチャネルに類似の電位センサー を持つにもかかわらずイオンの通り道ではなく酵素がつながる電位依存性ホスファターゼ( VSP )を発見し研究を行ってきました。VSP は単一の分子だけで電気信号をイオンの流れ以外に変換することができる唯一のタンパク質分子です。マウスを用いた研究では、VSP が精子の運動機能の制御に重要であることを解明し、VSP の生体における役割を報告しました(精子が持つ「電気」を感じる特殊な仕組みを解明: https://resou.osakau.ac.jp/ja/research/2019/20191129_2)。しかしながら、「どのように電気信号が酵素の働きである化学信号に変換されるのか」という根本的な分子のメカニズムは、国内外で研究が行われてきたにもかかわらず明らかにされてきませんでした 。
研究の内容
研究グループでは 、電位センサーに着目し、S4と呼ばれる電気信号を感じる本体の近傍に信号変換に重要な部位が存在することを発見しました。そこで Anapという蛍光を発する人工アミノ酸をその部位に導入し微細な構造の変化を調べることができる方法( Voltage clamp fluorometry ※4 )により、Hydrophobic spineと呼ばれる酵素部位の信号変換に重要な場所とS4とが直接相互作用することを明らかにしました(図2A)。これは、相互作用が電位センサーと酵素の共役を生み出し、その結果として電気信号が化学信号に変換されることを示しています。
さらに、VSPの立体構造を予測したところ、S4とHydrophobic spineが相互作用 する位置関係にあることも明らかとなりました(図2B)。
本研究成果が社会に与える影響(本研究成果の意義)
VSPはイノシトールリン脂質 PI(4,5)P2 を分解するツールとして 種々のタンパク質の機能が PI(4,5)P2に制御されるという発見に貢献してきただけでなく、VSPの電位センサーを蛍光タンパク質と結合させた分子は、神経細胞の電気活動を色の変化として可視化するツールとして利用されてきました。本研究成果により電位センサーによって 酵素のはたらきが誘導される詳細なメカニズムが明らかになったことで 、新しい電気化学変換のための分子ツールの開発が期待されます。 例えば細胞内の情報伝達物質を合成する酵素を電位センサーに繋げた分子ツールは、細胞が情報をやり取りする高度な仕組みの理解に貢献できると考えられます。 また、VSP は精子の運動機能を制御していることから、未だ謎の多い精子の動態の理解が進むことも期待できます。
さらに、VSPと共通する電位センサーを有するイオンチャネルは、種々の神経疾患や心疾患などに関連するタンパク質であり、生命活動に必須の電気信号がイオンの流れに変換されるメカニズムを理解する上で本研究は重要な成果です。
特記事項
本研究成果は、2022年6月21日(火)5時(日本時間)に米国科学誌「 Proceedings of the National Academy of Sciences of the United States of America PNAS 」(オンライン)に掲載されました 。
タイトル:”Interaction between S4 and the phosphatase domain mediates electrochemical coupling in voltage sensing phosphatase(VSP)”
著者名:Natsuki Mizutani 1 , Akira Kawanabe 1,4 , Yuka Jinno 1,5 , Hirotaka Narita 2,6 ,Tomoko Yonezawa 1,7 , Atsushi Nakagawa 2 , and Yasushi Okamura 1,3,*(*責任著者)
所属:
1.大阪大学 大学院医学系研究科 統合生理 学
2.大阪大学 蛋白質研究所 超分子構造解析学
3.大阪大学 大学院生命機能研究科
4.現所属:香川大学 医学部 分子生理学
5.現所属:大阪大学 大学院医学系研究科 循環器内科学
6.現所属:国立研究開発法人宇宙航空研究開発機構( JAXA
7.現所属:大阪大学 大学院医学系研究科 附属共同研究実習センター
DOI:https://doi.org /10.1073pnas.2200364119
本研究は、文部科学省科研費JP15H05901 、 JP20H05791(岡村康司)、日本学術振興会科研費 JP19K06585 (川鍋陽)、 JP19H03401 (岡村康司)、 JP21H02444 (中川敦史)、国立研究開発法人科学技術振興機構( JST CREST JPMJCR14M3 中川敦史 )、および公益財団法人三菱財団(岡村康司の助成を受けて行われました。また、水谷夏希は公益財団法人本庄国際奨学財団より第 25 期奨学生として支援を受けました。
用語説明
※1 電位依存性ホスファターゼ(VSP)
細胞膜電位の変化を感知する電位センサーと酵素部位から構成されるタンパク質分子 。イノシトールリン脂質 PI(4,5)P2を脱リン酸化する酵素のはたらき(ホスファターゼ活性)を示す。
※2 電位依存性イオンチャネル
細胞膜電位の変化を感知する電位センサーとイオンの通り道で あるポアドメインから構成される タンパク質分子。ナトリウムイオンを選択的に通すナトリウムチャネルやカリウムイオンを選択的に通すカリウムチャネルなど様々な種類が存在する。
※3イノシトールリン脂質PI(4,5)P2
細胞膜を構成する脂質の一種であると同時に、種々の電位依存性電位依存性イオンチャネルの機能を調節することが報告されている。イノシトールリン脂質は脂肪酸とイノシトール環から構成され、イノシトール環のリン酸化される部位とその数によって異なる機能を有する。PI(4,5)P2はイノシトール環のイノシトール環の4位と位と5位がリン酸化されており、VSPは5位を脱リン酸化する。
※4 Voltage clamp fluorometry
蛍光色素で標識した分子のある一部分の動きを検出する電気生理学的手法。膜電位を変化させた際の蛍光強度の変化を測定する。
【岡村康司教授のコメント】
VSPは単独で電気信号を化学信号に変換するユニークな分子として2005年にホヤのゲノム情報を契機に発見されましたが、細胞膜の中に埋まっている電位センサーが、細胞質の酵素部分をどのように調節するのかはこれまで大きな謎でした 。今回、非天然人工アミノ酸を組み込む手法や、タンパク質の構造予測の手法、多くの変異体について注意深く精緻な計測を続けた根気のお陰で、基本動作原理の理解に大きく近づくことができました 。






